 Atóm s viacerými elektrónmi
Atóm s viacerými elektrónmi
S výnimkou atómu vodíka, všetky atómy v neionizovanom stave obsahujú viac ako jeden elektrón. Bohrov model atómu bol schopný vysvetliť zákonitosti spektier atómu vodíka a vodíku podobných atómov. (Vodíku podobné atómy sú ionizované atómy len s jediným elektrónom na poslednej sfére, napr. Li2+).
V základnom stave jediný elektrón atómu vodíka je vo svojom najnižšom kvantovom stave, určenom štyrmi kvantovými číslami: hlavným kvantovým číslom n =1, orbitálnym (vedľajším) kvantovým l = 0, magnetickým kvantovým číslom ml = 0, magnetickým spinovým kvantovým číslom ms = ½. Stavy elektrónov v atóme sú určené štyrmi kvantovými číslami (n, l, ml, ms), ktorých označenie, dovolené hodnoty a význam udáva tabuľka 13.2.3.1 .
Tab. 13.2.3.1 Stavy elektrónov v atóme
|
Kvantové číslo |
Označenie |
Dovolené hodnoty |
Význam |
|
hlavné |
n |
1,2,3,.... |
vzdialenosť od jadra energiu stavu |
|
orbitálne |
l |
0, 1,2,....., (n-1) |
veľkosť orbitálneho momentu hybnosti L |
|
magnetické |
ml |
0, ±1, ±2, .... ±l |
veľkosť Lz (priemet L do osi z) |
|
magnetické spinové |
ms |
±1/2 |
veľkosť Sz (priemet spinového momentu hybnosti S do osi z) |
Čo je však základný stav atómu s viacerými elektrónmi, napr. u uránu s 92 elektrónmi? Je možné určiť koľko elektrónov môže mať daná množina kvantových čísiel (n, l, ml, ms)? Odpoveď na tieto otázky, na základe štúdia atómových spektier podal rakúsky teoretický fyzik Wolfgan Pauli (1900- 1958). Vychádzal zo skutočností, že v spektrách rôznych prvkov, okrem vodíka, chýba vždy rad čiar, ktoré odpovedajú prechodom medzi stavmi s istými kombináciami kvantových čísiel. Táto skutočnosť bola sformulovaná Nielsom Bohrom v tzv. výberovom pravidle:
Dovolený je len taký preskok elektrónu z dráhy jednej sféry (orbity) do dráhy inej sféry, pri ktorom:
· sa hlavné kvantové číslo môže meniť o ľubovolný počet jednotiek, nemôže však ostať nezmenené;
· vedľajšie kvantové číslo l sa zmení o jednotku, t.j. D l = ±1;
· magnetické kvantové číslo ostane nezmenené, alebo sa zmení o jednotku, t.j. D m l = 0, ±1.
Wolfgan Pauli ukázal, že každá chýbajúca spektrálna čiara a im zodpovedajúci chýbajúci atómový stav, predstavuje dva alebo viacej elektrónov s rovnakými kvantovými číslami. Konštatovanie tohto empirického poznania sformuloval do vylučovacieho princípu, dnes známeho pod názvom
Pauliho vylučovací princíp:
Žiadne dva elektróny v atóme sa nemôžu nachádzať v rovnakom kvantovom stave. Každý elektrón v atóme musí mať rôzny súbor štyroch kvantových čísiel n, l, ml a ms.
Pauliho princíp celkom presne určuje hranicu pre počet elektrónov v danej sfére, resp. podsfére. Podsféra je charakterizovaná určitým hlavným kvantovým číslom a orbitálnym kvantovým číslom l. Pre každé l existuje 2l+1 rôznych hodnôt magnetického kvantového čísla ml a dve možné hodnoty spinového kvantového čísla ms. Každá podsféra môže obsahovať najviac 2(2l+1) elektrónov a každá sféra s daným n môže teda obsahovať maximálny počet elektrónov 2n2, pretože
![]() (13.2.3.1)
(13.2.3.1)
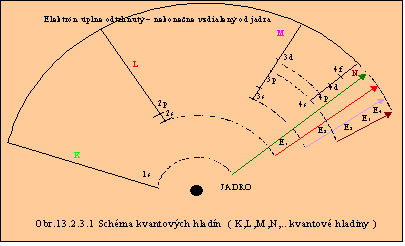
Atómová sféra alebo podsféra, ktorá je obsadená maximálnym počtom elektrónov, sa nazýva uzavretá sféra, resp. podsféra. Obsadzovanie elektrónov v atóme pre n = 1 až 4 podáva tabuľka 13.2.3.2, z ktorej aj vyplýva usporiadanie prvkov v Mendelejevovej periodickej sústave prvkov. Možné prechody medzi jednotlivými sférami sú znázornené na obr. 13.2.3.1
Tab. 13.2.3.2 Obsadzovanie elektrónov v atóme s viacerými elektrónmi s hlavným kvantovým číslom n = 1- 4.
|
n |
Označenie sféry |
l |
názov podsféry
l |
Označenie dráh elektrónov |
ml |
Počet dráh |
ms |
počet elektrónov |
|
|
v podsfére |
celkový vo sfére |
||||||||
|
1 |
K |
0 |
s |
1s |
0 |
1 |
±1/2 |
2 |
2.12 = 2 |
|
2 |
L |
0 1 |
s p |
2s 2p |
0 -1,0,+1 |
1 3 |
±1/2 ±1/2 |
2 6 |
2.22 = 8
|
|
3 |
M
|
0 1 2 |
s p d |
3s 3p 3d |
0 -1,0,+1 -2,1,0,+1,+2 |
1 3 5 |
±1/2 ±1/2 ±1/2 |
2 6 10 |
2.32 = 18
|
|
4 |
N |
0 1 2 3 |
s p d f |
4s 4p 4d 4f |
0 -1,0,+1 -2,-1,0,+1,+2 -3,-2,-1,0+1,+2,+3
|
1 3 5 7
|
±1/2 ±1/2 ±1/2 ±1/2 |
2 6 10 14 |
2.42 = 32 |
Všimnime si, že usporiadanie do jednotlivých riadkov v tabuľke 13.2.3.2 odpovedá skutočnosti zapĺňania orbít s hlavným kvantovými číslami 1 až 4. V prírode sa pozorovalo zaplnenie až po n =7, ktoré odpovedá Mendelejevovej periodickej tabuľky.

Druhým základným pravidlom, ktorým sa riadi elektrónová štruktúra s mnohými elektrónmi, je:
· Systém častíc je stabilný, ak jeho celková energia je minimálna .
Dôsledkom tohto pravidla je i skutočnosť, že kedykoľvek je to len možné, elektróny v atóme vo všeobecnosti ostávajú nespárené, t.j. majú rovnobežné spiny. Tento princíp sa nazýva Hundove pravidlo.
Poznámka: K vysvetleniu ostatných skutočností v mnohoelektrónových atómoch, je nevyhnutné sa oboznámiť napr. s celkovým momentom hybnosti J, definovaným ako vektorový súčet hybností jednotlivých elektrónov, a to momentov ako orbitálnych tak i spinových. Keďže počet elektrónov (ako i počet protónov) v neutrálnom atóme určuje protónové číslo Z, celkový moment hybnosti J
J = (L1+ L2+ L3+....+ LZ) + ( S1+ S2 +S3 +.... +SZ ).
Sú možné dva spôsoby skladania orbitálnych a spinových momentov v mnohoelektrónových atómoch.
Pri skladaní orbitálnych a spinových momentov pri mmnohoelektrónových atómoch sa jedná o tzv. L-S väzbu lebo J-J väzbu. ( V prípade záujmu pozri napr. monografiu Artura Beisera: Úvod do modernej fyziky).
Merateľný je len priemet vektora J do smeru vonkajšieho magnetického poľa Jz,, čo je dôsledkom Heisenbergrovho princípu neurčitosti, o ktorom pojednáme v samostatnej časti.
S týmito podrobnosťami sa čitateľ tiež môže oboznámiť bližšie v monografiách kvantovej fyziky.
Kontrolné otázky
- Akým súborom čísiel je určený kvantový stav elektrónu v atóme ?
- Ktoré kvantové číslo určuje orbitu, na ktorej sa pohybuje elektrón?
- Kedy hovoríme, že sa elektrón nachádza v základnom stave?
- Vyslovte Bohrov vylučovací princíp.
- Môžeme pozorovať preskoky elektrónov medzi jednotlivými podsférami danej sféry?
- Aký význam má magnetické kvantové číslo m l ?
- Aký význam má hlavné kvantové číslo n?
- Aký význam má orbitálne kvantové číslo l?
- Vyslovte Pauliho vylučovací princíp.
- Na akom princípe možno vysvetliť usporiadanie atómov do periodickej sústavy prvkov?
- Vysvetlite prečo v prvej perióde Mendelejevovej tabuľky sa nenachádzajú na voľných miestach iné prvky.
- Akému kvantovému číslu prináleží druhý riadok v periodickej sústave prvkov?
- Na základe akého pravidla sa vysvetľuje feromagnetizmus železa? (Súvisí s orientáciou spinov).

